Les effets du COVID sur le système cardio-vasculaire humain
Douze études scientifiques et médicales
INTRODUCTION : Dans le cadre de la thématique du LongCovidAwareness de 2026, nous commençons par un extrait de la revue systématique European Journal of Preventive Cardiology (n°5 dans le sommaire) :
« Les maladies cardiovasculaires font partie des séquelles post-infectieuses aiguës [du COVID], de nombreux patients présentant des symptômes ou des complications évocateurs d’arythmies, d’événements ischémiques ou thrombotiques, d’inflammation, et certains allant jusqu’à l’arrêt cardiaque et la mort subite. Il est indéniable que le COVID long interagit de manière complexe avec le système cardiovasculaire, ce dernier jouant un rôle important non seulement dans la présentation clinique, mais aussi dans la physiopathologie et la stratification du risque de COVID long ».
Quelques chiffres COVID Long.
- RISQUE X 2 DE DÉCÈS à un an pour les personnes COVID Long par rapport à celles non infectées par le COVID, principalement d’effets cardiovasculaires : Étude sur une large cohorte USA, JAMA 2023.
On peut y constater que les personnes atteintes de COVID long avaient aussi :
UN RISQUE X 3,6 d’embolie pulmonaire,
UN RISQUE X 2,35 d’arythmie cardiaque,
UN RISQUE X 2,17 D’AVC ischémique, etc.
Dans une revue systématique récente sur le COVID long, on retrouvait ces mêmes type de chiffres mais aussi un risque plus élevé d’hypertension (HR 1,70), d’insuffisance cardiaque (HR 1,72), etc.
Quelques chiffres COVID
- UN RISQUE X 2 DE MACE (événements cardiovasculaires majeurs) pour les personnes infectées au SARS-CoV-2 par rapport aux non infectées (étude n°2 dans le sommaire). L’infection COVID = risque cardiovasculaire en soi.
- Risque démesurément élevé de thrombose dans la semaine suivant l’infection au COVID-19, sur une étude de cohorte de 48 millions de personnes en Angleterre et pays de Galles en 2020. Le risque décroit ensuite rapidement au cours du temps, mais restait élevé durant 49 semaines.
- HYPERTENSION suite au COVID : RISQUE X 2,23 par rapport à la grippe pour les patients hospitalisés, RISQUE X 1,52 pour les patients COVID non hospitalisés (Voir l’étude n°11 de ce recueil).
Nous mettons aussi à disposition le résumé d’une revue de littérature publiée dans Cureus, bien réalisée, sur le COVID long et le système cardiovasculaire, avec pistes de traitements futurs : lien ici
Sommaire :
1 – Remodelage de l’architecture intracellulaire au cours de l’infection de l’endothélium humain par le SRAS-CoV-2
Nature, Scientific Reports, 2024 : Lien
Les données cliniques indiquent que le COVID-19 provoque des complications cardiovasculaires, quelle que soit la gravité de la maladie. Dans ce travail, nous avons montré que l’infection par le SRAS-CoV-2 provoque un dysfonctionnement vasculaire dû à la modification de l’élasticité des cellules endothéliales. Nous avons utilisé des cellules endothéliales pulmonaires humaines (HPAEC) exprimant le récepteur ACE2 comme modèle d’endothélium. Ce système reproduit les conditions in vivo, car il permet l’entrée du virus mais pas sa réplication. Comme référence, nous avons utilisé les cellules épithéliales A549, un modèle bien décrit qui permet une réplication productive du SRAS-CoV-2. Nous montrons que l’infection des HPAEC entraîne une perte d’élasticité des cellules, qui est corrélée à une polymérisation accrue des filaments d’actine et à l’induction de la réponse inflammatoire. Au contraire, les cellules épithéliales A549 supportant la réplication virale présentent une élasticité accrue. Nous avons également montré que l’élasticité des cellules endothéliales était altérée après une infection par les variants Alpha, Beta et Delta. Par conséquent, nous pensons que l’infection non productive par le SRAS-CoV-2 associée à une perte d’élasticité de l’endothélium peut être cliniquement pertinente et entraîner un dysfonctionnement et des lésions de ce tissu.
2 – COVID-19 est un équivalent du risque de maladie coronarienne et présente une interaction génétique avec le groupe sanguin ABO
Arteriosclerosis, Thrombosis, and Vascular Biology, 2024 : Lien
CONTEXTE
COVID-19 est associé à un risque aigu d’événements cardiaques indésirables majeurs (MACE), y compris l’infarctus du myocarde, l’accident vasculaire cérébral et la mortalité (toutes causes confondues). Cependant, la durée et les déterminants sous-jacents du risque accru de maladie cardiovasculaire et de MACE après COVID-19 ne sont pas connus.
MÉTHODES
Les données de la UK Biobank ont été utilisées pour identifier les cas de COVID-19 (n=10 005) qui étaient positifs aux tests basés sur la réaction en chaîne de la polymérase (PCR+) pour l’infection par le SRAS-CoV-2 (n=8062) ou qui ont reçu des codes de la Classification internationale des maladies version-10 (CIM-10) pour le COVID-19 (n=1943) entre le 1er février 2020 et le 31 décembre 2020. Des témoins de la population (n=217 730) et des témoins appariés par score de propension (n=38 860) ont également été tirés de la UK Biobank au cours de la même période. Des modèles d’aléas proportionnels ont été utilisés pour évaluer l’association de COVID-19 avec le risque à long terme (>1000 jours) de MACE et en tant qu’équivalent du risque de maladie coronarienne. Des analyses supplémentaires ont examiné si COVID-19 interagissait avec des déterminants génétiques pour affecter le risque de MACE et ses composantes.
RÉSULTATS
Le risque de MACE était élevé dans les cas de COVID-19 à tous les niveaux de gravité (HR, 2,09 [IC à 95 %, 1,94-2,25] ; P<0,0005) et dans une plus large mesure dans les cas hospitalisés pour COVID-19 (HR, 3,85 [IC à 95 %, 3,51-4,24] ; P<0,0005). L’hospitalisation pour COVID-19 représentait un risque équivalent de maladie coronarienne puisque le risque incident de MACE parmi les cas sans antécédents de maladie cardiovasculaire était encore plus élevé que celui observé chez les patients atteints de maladie cardiovasculaire sans COVID-19 (HR, 1,21 [IC à 95 %, 1,08-1,37] ; P<0,005). Une interaction génétique significative a été observée entre le locus ABO et l’hospitalisation pour COVID-19 (Pinteraction=0,01), le risque d’événements thrombotiques étant plus élevé chez les sujets de groupe sanguin non-O (HR, 1,65 [95% CI, 1,29-2,09] ; P=4,8×10-5) que chez les sujets de groupe sanguin O (HR, 0,96 [95% CI, 0,66-1,39] ; P=0,82).
CONCLUSIONS
L’hospitalisation pour COVID-19 représente un équivalent de risque de maladie coronarienne, avec un risque d’infarctus du myocarde et d’accident vasculaire cérébral post-aigu particulièrement élevé chez les groupes sanguins non-O. Ces résultats peuvent avoir des implications cliniques importantes et représentent, à notre connaissance, l’un des premiers exemples d’interaction gène-pathogène pour les événements thrombotiques.
3 – Association du COVID-19 avec le risque à court et à long terme de maladie cardiovasculaire et de mortalité : une cohorte prospective de la UK Biobank
Cardiovascular Research, 2023 – Lien
OBJECTIFS
Cette étude vise à évaluer les associations à court et à long terme entre COVID-19 et le développement de maladies cardiovasculaires (MCV) et la mortalité dans la population générale.
METHODES ET RESULTATS
Une cohorte prospective de patients infectés par COVID-19 entre le 16 mars 2020 et le 30 novembre 2020 a été identifiée à partir de la UK Biobank, et suivie pendant 18 mois, jusqu’au 31 août 2021. Sur la base de l’âge (à 5 ans près) et du sexe, chaque cas a été apparié au hasard avec un maximum de 10 participants sans infection par COVID-19 issus de deux cohortes – une cohorte contemporaine entre le 16 mars 2020 et le 30 novembre 2020 et une cohorte historique entre le 16 mars 2018 et le 30 novembre 2018. Les caractéristiques entre les groupes ont été ajustées avec une pondération moyenne marginale basée sur le score de propension par stratification. Pour déterminer l’association du COVID-19 avec les MCV et la mortalité dans les 21 jours suivant le diagnostic (phase aiguë) et après cette période (phase post-aiguë), une régression de Cox a été utilisée. Au cours de la phase aiguë, les patients atteints de COVID-19 (n = 7584) ont été associés à un risque à court terme significativement plus élevé de MCV {ratio de risque (HR) : 4,3 [intervalle de confiance à 95 % (IC) : 2,6- 6,9] ; HR : 5. 0 (IC 95 % : 3,0-8,1) } et de mortalité toutes causes confondues [HR : 81,1 (IC 95 % : 58,5-112,4) ; HR : 67,5 (IC 95 % : 49,9-91,1)] par rapport aux témoins contemporains (n = 75 790) et historiques (n = 75 774), respectivement.
En ce qui concerne la phase post-aiguë, les patients atteints de COVID-19 (n = 7139) présentaient toujours un risque significativement plus élevé de MCV à long terme [HR : 1,4 (IC 95 % : 1,2-1,8) ; HR : 1,3 (IC 95 % : 1. 1- 1,6)] et de mortalité toutes causes confondues [HR : 5,0 (IC 95% : 4,3-5,8) ; HR : 4,5 (IC 95% : 3,9-5,2) par rapport aux témoins contemporains (n = 71 296) et historiques (n = 71 314), respectivement.
CONCLUSIONS
L’infection par le COVID-19, y compris le COVID long, est associée à des risques accrus de MCV et de mortalité à court et à long terme. La surveillance continue des signes et symptômes de développement de ces complications cardiovasculaires après le diagnostic et jusqu’à au moins un an après la guérison peut être bénéfique pour les patients infectés, en particulier ceux qui souffrent d’une maladie grave.
4 – Prévalence des anomalies cardiovasculaires et pulmonaires persistantes à l’imagerie TEP/IRM et DECT (scanner double énergie) chez les patients atteints de COVID long
Journal of Nuclear Medicine, april 2025 – Lien
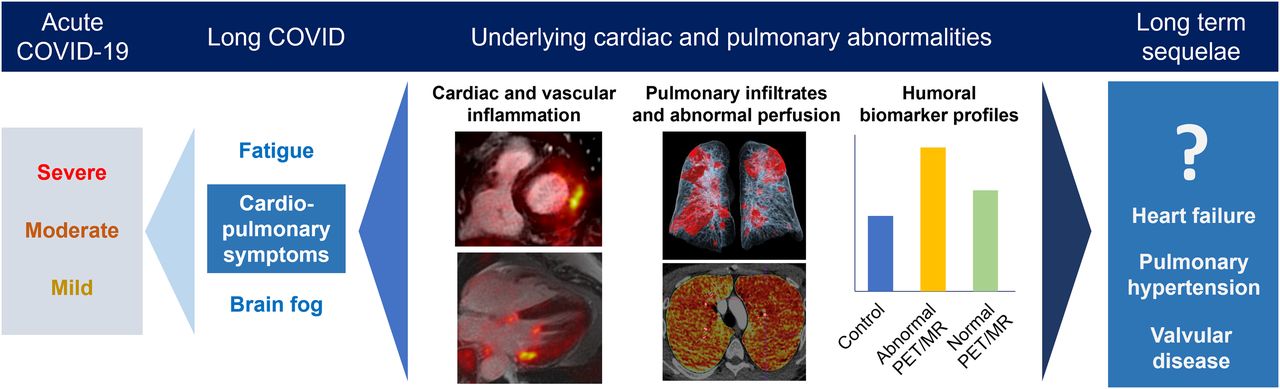
L’objectif de cette étude est de décrire la prévalence des manifestations cardiopulmonaires inflammatoires dans une cohorte prospective de patients atteints de maladie à coronavirus (LC) longue.
MÉTHODES
Les sujets ayant des antécédents d’infection par la maladie à coronavirus 2019, des symptômes cardiopulmonaires persistants 9 à 12 mois après l’infection initiale et une évaluation clinique compatible avec la LC ont subi une TEP/IRM cardiopulmonaire au 18 F-FDG, une TDM pulmonaire en double énergie (DECT) et une analyse des protéines plasmatiques (sous-groupe). Un groupe témoin qui comprenait des sujets ayant des antécédents d’infection aiguë par le coronavirus 2 du syndrome respiratoire aigu sévère mais sans symptômes cardiopulmonaires au recrutement a également été caractérisé.
RÉSULTATS
Quatre-vingt-dix-huit patients (âge médian, 48,5 ans ; 47 % d’hommes) ont été recrutés. Le symptôme de LC le plus courant était l’essoufflement (80 %), et 27 % des participants ont été hospitalisés.
Parmi les sujets, 90 % présentaient des anomalies au DECT, avec 67 % et 59 % des participants présentant respectivement des infiltrats pulmonaires et une perfusion anormale. La TEP/IRM était anormale pour 57 % des sujets : 24 % présentaient une atteinte cardiaque évoquant une myocardite, 22 % présentaient une captation évoquant une péricardite, 11 % présentaient une captation périannulaire et 30 % présentaient une captation vasculaire (aortique ou pulmonaire). Il n’y avait aucune captation myocardique, péricardique, périannulaire ou pulmonaire sur les scanners TEP/IRM du groupe témoin ( n = 9). L’analyse des concentrations de protéines plasmatiques a montré des différences significatives entre le groupe LC et le groupe témoin. Enfin, le profil protéique plasmatique était significativement différent entre les patients LC avec TEP/IRM anormale et normale.
CONCLUSION
Chez les sujets COVID long évalués jusqu’à un an après l’infection par le COVID-19, nos résultats indiquent une prévalence élevée d’anomalies sur le PET/IRM et le DECT, ainsi que des différences significatives dans le profil des biomarqueurs périphériques, ce qui pourrait justifier une surveillance plus poussée pour exclure le développement de complications telles que l’hypertension pulmonaire et la maladie valvulaire.
5 – Les maladies cardiovasculaires dans le cadre du COVID long : une revue systématique
European Journal of Preventive Cardiology, 2024 : Lien
RÉSUMÉ
Définition et enjeux
Le COVID long, défini par l’OMS comme la persistance ou l’apparition de symptômes trois mois après l’infection initiale par le SARS-CoV-2 (durant au moins deux mois sans autre explication), touche jusqu’à 45 % des survivants du COVID-19. Parmi les symptômes, les atteintes cardiovasculaires (douleurs thoraciques, palpitations, essoufflement, syncopes) figurent parmi les plus fréquents, représentant la 3ème manifestation clinique la plus courante.
Mécanismes physiopathologiques
Les mécanismes impliquent principalement une réponse immunitaire et inflammatoire persistante, avec une élévation prolongée de cytokines pro-inflammatoires (TNF-α, IL-1, IL-6), associées à des arythmies, une inflammation myocardique et des auto-anticorps dirigés contre le système cardiovasculaire. L’implication d’une prédisposition génétique ou d’un déséquilibre du système rénine-angiotensine reste incertaine.
Les facteurs de risque de COVID Long établis sont l’obésité, insuffisance cardiaque préexistante, cardiopathie ischémique (risque accru de 28 à 34 %). D’autres comme l’hypertension, diabète, fibrillation auriculaire sont plus controversés (données contradictoires).
Les marqueurs potentiels sanguins (composants du complément, monocytes non classiques) sont à l’étude pour le diagnostic, mais aucun test n’est encore validé en routine.
Manifestations cardiovasculaires
Les symptômes fréquents sont les douleurs thoraciques (89 % des cas dans certaines études), palpitations, dyspnée et autres. On peut observer des anomalies cardiaques telles que l’altération de la déformation ventriculaire, œdème ou fibrose myocardique (détectés par IRM cardiaque), même en l’absence de symptômes.
Le risque nouvelles maladies cardiovasculaires est accru (x1,6), incluant troubles du rythme, insuffisance cardiaque, événements thrombotiques.
Prévention et prise en charge
La vaccination : réduit le risque de COVID long de 40 %. Les antiviraux (nirmatrelvir, molnupiravir) diminuent l’incidence du COVID long, notamment chez les patients à haut risque. Quant à la prise en charge, elle est actuellement symptomatique, avec des essais en cours sur l’ivabradine, l’efgartigimod, la réadaptation cardiaque et le biofeedback.
Perspectives
La recherche se concentre sur l’identification de biomarqueurs pour un diagnostic précoce et le développement de thérapies ciblées. Le pronostic à long terme reste incertain, une part des patients voyant leurs symptômes s’atténuer avec le temps, l’autre non.
Conclusion
Le COVID long représente un défi clinique majeur, avec une forte prévalence d’atteintes cardiovasculaires. Les patients atteints de COVID long peuvent développer de nouvelles maladies cardiovasculaires telles que le diabète, des arythmies et une insuffisance cardiaque. Les symptômes cardiaques les plus fréquents sont les douleurs thoraciques, les palpitations, la dyspnée et les syncopes. Une stratification des risques et une prise en charge précoce (vaccination, antiviraux) sont essentielles pour limiter les complications.
6 – Association entre l’infection par le SRAS-CoV-2 et la progression de la plaque athéroscléreuse lors de l’angiographie coronaire par tomodensitométrie et les événements cardiovasculaires indésirables
Radiology, 2025 : Lien
BUT
Évaluer l’impact de l’infection par le SRAS-CoV-2 sur l’inflammation coronaire et les plaques en utilisant l’angiographie coronarienne par tomodensitométrie (CCTA) et l’impact sur les résultats cliniques.
MATÉRIELS ET MÉTHODES
Cette analyse rétrospective d’une étude prospective a porté sur des patients consécutifs ayant subi une CCTA en série entre septembre 2018 et octobre 2023. Le volume d’athérome (PAV) quantitatif total et compositionnel en pourcentage et la variation annualisée du PAV, la présence de plaques à haut risque et l’atténuation du tissu adipeux péricoronaire spécifique à la lésion (PCAT) au départ et au suivi ont été comparés entre les lésions chez les patients infectés et non infectés par le SARS-CoV-2. Les relations entre l’infection par le SARS-CoV-2 et l’échec de la lésion cible, qui est un composite de décès cardiaque, d’infarctus du myocarde de la lésion cible et de revascularisations de la lésion cible d’origine clinique, ont été évaluées à l’aide de modèles de Cox et de tests du rang log.
RÉSULTATS
Chez 803 patients (âge moyen, 63,9 ans ± 10,1 [ET] ; 543 [67,6 %] patients de sexe masculin), 2108 lésions des artères coronaires ont été évaluées chez des patients infectés par le SARS-CoV-2 ( n = 690) et 480 lésions des artères coronaires ont été évaluées chez des patients non infectés par le SARS-CoV-2 ( n = 113). Par rapport aux lésions chez les patients non infectés par le SARS-CoV-2, les lésions chez les patients infectés par le SARS-CoV-2 ont montré une progression plus rapide de la VAP globale (0,90 % par an ± 0,91 contre 0,62 % par an ± 0,68, respectivement ; P < 0,001) et de la VAP non calcifiée (0,78 % par an ± 0,79 contre 0,42 % par an ± 0,45, respectivement ; P < 0,001). Français L’incidence de devenir une plaque à haut risque (21,0 % [442 sur 2108] contre 15,8 % [76 sur 480] ; P = 0,03) et une atténuation du PCAT de −70,1 HU ou plus (27,1 % [571 sur 2108] contre 19,8 % [95 sur 480] ; P < 0,001) au suivi était également plus élevée dans les lésions chez les patients infectés par le SARS-CoV-2 ( P < 0,001), malgré une prévalence similaire au départ. Les lésions chez les patients atteints de COVID-19 présentaient un risque plus élevé d’échec de la lésion cible (10,4 % contre 3,1 %, respectivement ; rapport de risque ajusté, 2,90 ; IC à 95 % : 1,68, 5,02 ; P < 0,001).
CONCLUSION
L’infection par le SARS-CoV-2 a été associée à une progression plus rapide du volume de plaque lésionnelle et à une augmentation de l’incidence de devenir une plaque à haut risque. Les plaques coronaires chez les patients atteints de COVID-19 étaient plus susceptibles d’avoir un risque élevé d’échec de la lésion ciblée.
(AJOUT : Étude qui montre l’association de l’infection SARS-CoV-2 à une ↗️ accélérée du volume global d’athérosclérose coronaire, à une ↘️ de la calcification des plaques, à une ↗️ des caractéristiques des plaques à haut risque et un risque accru de réponse hyperinflammatoire. De plus, l’infection SARS-CoV-2 a ↗️ le risque de développer des événements cardiovasculaires graves.)
7 – La fibrine est à l’origine de la thrombo-inflammation et de la neuropathologie pour le COVID-19 – et le covid long
Nature, 2024 : Lien
Les événements thrombotiques et les symptômes neurologiques mettant en jeu le pronostic vital sont fréquents dans la COVID-19 et persistent chez les patients atteints d’un COVID long présentant des séquelles post-aiguës de l’infection par le SARS-CoV-21,2,3,4. Malgré les preuves cliniques1,5,6,7, les mécanismes sous-jacents de la coagulopathie dans le COVID-19 et ses conséquences sur l’inflammation et la neuropathologie restent mal compris et les options thérapeutiques sont insuffisantes. Le fibrinogène, composant structurel central des caillots sanguins, se dépose en abondance dans les poumons et le cerveau des patients atteints de COVID-19, est corrélé à la gravité de la maladie et constitue un biomarqueur prédictif des déficits cognitifs post-COVID-191,5,8,9,10. Nous montrons ici que la fibrine se lie à la protéine de pointe du SARS-CoV-2, formant des caillots sanguins pro-inflammatoires qui entraînent une thrombo-inflammation systémique et une neuropathologie dans le COVID-19. La fibrine, agissant par l’intermédiaire de son domaine inflammatoire, est nécessaire au stress oxydatif et à l’activation des macrophages dans les poumons, tandis qu’elle supprime les cellules tueuses naturelles après l’infection par le SRAS-CoV-2. La fibrine favorise la neuroinflammation et la perte neuronale après l’infection, ainsi que l’activation du système immunitaire inné dans le cerveau et les poumons, indépendamment de l’infection active. Un anticorps monoclonal ciblant le domaine inflammatoire de la fibrine offre une protection contre l’activation microgliale et les lésions neuronales, ainsi que contre la thrombo-inflammation dans les poumons après l’infection. Un anticorps monoclonal ciblant le domaine inflammatoire de la fibrine offre une protection contre l’activation microgliale et les lésions neuronales, ainsi que contre la thrombo-inflammation dans les poumons après l’infection. Ainsi, la fibrine est le moteur de l’inflammation et de la neuropathologie dans l’infection par le SRAS-CoV-2, et l’immunothérapie ciblant la fibrine peut représenter une intervention thérapeutique pour les patients atteints de COVID-19 aiguë et de COVID long.
8 – Vieillissement vasculaire accéléré après une infection à la COVID-19 : l’étude CARTESIAN
The European Heart Journal, 2025 : Lien
CONTEXTE ET OBJECTIF
De plus en plus de données suggèrent que les personnes ayant survécu au COVID-19 présentent des complications cardiovasculaires à long terme, possiblement dues à des lésions vasculaires. Cette étude visait à déterminer si un vieillissement vasculaire accéléré survient après une infection par le COVID-19 et, le cas échéant, à en identifier les facteurs déterminants.
METHODES
Cette étude de cohorte prospective et multicentrique a inclus 34 centres dans 16 pays à travers le monde, répartis en 4 groupes de participants : un groupe témoin négatif pour la COVID-19 (i) et trois groupes de personnes ayant été récemment exposées (6 ± 3 mois) au SARS-CoV-2 : non hospitalisées (ii), hospitalisées en service de médecine générale (iii) et hospitalisées en soins intensifs (iii). Le critère d’évaluation principal était la vitesse de l’onde de pouls carotido-fémorale (VOP), un biomarqueur reconnu de la rigidité des grosses artères.
RESULTATS
2 390 individus (âge moyen : 50 ± 15 ans, 49,2 % de femmes) ont été recrutés. Après ajustement pour les facteurs de confusion, tous les groupes positifs à la COVID-19 présentaient une vitesse de l’onde de pouls (VOP) plus élevée (+0,41, +0,37 et +0,40 m/s pour les groupes 2 à 4, p < 0,001, p = 0,001 et p = 0,003 respectivement) que les témoins [VOP moyenne ajustée : 7,53 (7,09 ; 7,97) m/s (IC à 95 %)]. Dans les analyses stratifiées par sexe, les différences de VOP étaient significatives chez les femmes [VOP (+0,55, +0,60 et +1,09 m/s pour les groupes 2 à 4, p < 0,001 pour tous)], mais pas chez les hommes. Chez les femmes positives à la COVID-19, la persistance des symptômes était associée à une vitesse d’onde de pouls (VOP) plus élevée, indépendamment de la gravité de la maladie et des facteurs de confusion cardiovasculaires [VOP ajustée : 7,52 m/s (IC à 95 % : 7,09 ; 7,96) vs 7,13 m/s (IC à 95 % : 6,67 ; 7,59), p < 0,001]. Une VOP stable ou améliorée a été observée après 12 mois dans le groupe COVID+, tandis qu’une progression a été constatée dans le groupe COVID−.
Extrait du texte entier : « Il est intéressant de noter que l’élévation de la vitesse de l’onde de pouls (VOP) était manifeste même chez les patients COVID+ non hospitalisés, présentant des formes légères de COVID-19, à un degré similaire à celui observé chez les femmes COVID+ hospitalisées en médecine générale. L’ampleur du vieillissement vasculaire accéléré induit par la COVID-19 dans ces deux groupes de patients est cliniquement pertinente, d’environ +0,5 m/s par rapport aux femmes COVID−. Si l’on compare cette valeur aux valeurs de référence de la VOP et à une méta-analyse d’études longitudinales, pour une personne de 60 ans ayant une tension artérielle normale, une VOP de +0,5 m/s correspond approximativement à +5 ans de vieillissement vasculaire et à une augmentation de 3 % du risque d’événements cardiovasculaires. » Ce vieillissement serait partiellement réversible à long terme. Il faut noter que « la présence de symptômes persistants 6 mois après l’infection par la COVID-19 était significativement associée à une augmentation de la vitesse de l’onde de pouls (VOP) chez les femmes, quel que soit le degré de gravité de la maladie et indépendamment des autres facteurs de confusion. »
CONCLUSIONS
Nos données indiquent que l’infection au COVID-19 est associée à un vieillissement vasculaire accéléré à moyen et long terme, particulièrement chez les femmes (équivalent + 5 ans ). Des études complémentaires sont nécessaires pour confirmer ces résultats par des études avant-après et pour élucider l’effet de la vaccination, ainsi que pour démontrer si ces altérations précliniques sont associées à des événements cardiovasculaires cliniques ; si les nouveaux variants du SARS-CoV-2 sont capables d’induire un vieillissement vasculaire accéléré dans la même mesure, et si les réinfections sont associées à une rigidité artérielle accrue.
9 – Prévalence des symptômes cardiovasculaires dans le syndrome COVID-19 post-aigu : une méta-analyse
BMC Medicine, 2025 : Lien
CONTEXTE
Depuis son apparition en 2019, le COVID-19 continue de représenter une menace importante pour la santé physique et mentale de la population mondiale, ainsi que pour les systèmes de santé du monde entier (Raman et al., Eur Heart J 43:1157-1172, 2022). De nouvelles données indiquent que le COVID-19 peut entraîner un syndrome post-aigu du COVID-19 (PACS) avec des implications cardiovasculaires, potentiellement dues à des facteurs tels que l’interaction de l’ACE2 avec les virus, l’inflammation systémique et le dysfonctionnement endothélial. Cependant, les recherches sur les manifestations cardiovasculaires du PACS sont encore peu nombreuses, ce qui peut retarder le développement de stratégies de traitement optimales pour les patients concernés. Il est donc essentiel d’étudier la prévalence des séquelles cardiovasculaires chez les patients atteints de COVID-19 et de déterminer si l’infection par COVID-19 constitue un facteur de risque indépendant pour ces résultats.
METHODES UTILISEES
Cette méta-analyse a respecté les directives PRISMA et a été enregistrée dans PROSPERO (CRD42024524290). Une recherche systématique dans PubMed, Embase et la Cochrane Library a été effectuée jusqu’au 17 mars 2024. Les résultats primaires comprenaient l’hypertension, les palpitations et les douleurs thoraciques, avec des estimations d’effets groupés rapportées sous forme de proportions et de rapports de cotes (RC) avec des intervalles de confiance (IC) à 95 %. Des analyses de sensibilité et de sous-groupes ont été réalisées pour évaluer la robustesse des résultats et identifier les sources d’hétérogénéité.
RESULTATS
Au total, 37 études portant sur 2 965 467 patients ont été incluses dans l’analyse. Les résultats regroupés des études cas-témoins ont révélé que, par rapport au groupe témoin, l’OR de la douleur thoracique dans le groupe COVID-19 était de 4,0 (IC à 95 % : 1,6, 10,0). Les OR pour les palpitations et l’hypertension étaient respectivement de 3,4 (IC 95% : 1,1, 10,2) et de 1,7 (IC 95% : 1,6, 1,8). Les proportions de patients PACS présentant des douleurs thoraciques, des palpitations et une hypertension comme séquelles étaient respectivement de 22 % (IC 95 % : 14 %, 33 %), 18 % (IC 95 % : 13 %, 24 %) et 19 % (IC 95 % : 12 %, 31 %).
CONCLUSIONS
Nos résultats indiquent que 15 % des patients atteints de COVID-19 présentent des séquelles cardiovasculaires. En outre, l’infection par COVID-19 augmente de manière significative la probabilité de développer ces séquelles par rapport aux personnes non infectées. Les recherches futures devraient se concentrer sur l’étude des mécanismes pathologiques sous-jacents et sur le développement de stratégies de prévention et de gestion ciblées.
10 – Prévention et gestion des maladies cardiovasculaires dans le cadre de la COVID-19 : déclaration de consensus clinique de l’Association européenne de cardiologie préventive, de l’Association européenne d’imagerie cardiovasculaire, de l’Association des infirmières cardiovasculaires et des professions connexes, de l’Association européenne des interventions cardiovasculaires percutanées et de l’Association d’insuffisance cardiaque de l’ESC
European Journal of preventive Cardiology, 2025 : Lien
EXTRAIT
La COVID-19 peut déclencher et aggraver les complications cardiovasculaires, observées aussi bien pendant la phase aiguë de l’infection qu’en phase post-aiguë, certaines personnes développant des séquelles à long terme regroupées sous le terme de COVID long. De plus, la réinfection et les effets indésirables des vaccins contre la COVID-19 peuvent contribuer à la survenue d’événements cardiovasculaires.
Cette déclaration de consensus clinique, élaborée par les associations de la Société Européenne de Cardiologie, vise à fournir un aperçu complet des stratégies de prévention cardiovasculaire à tous les stades de la COVID-19. Celles-ci incluent la prise en charge du risque cardiovasculaire associé à l’infection aiguë, à une infection antérieure, au COVID long, à la réinfection et aux événements post-vaccinaux. Les principales recommandations portent sur la prévention et la prise en charge des manifestations cardiovasculaires chez les patients atteints de COVID-19 aiguë ou ayant des antécédents de COVID-19, la mise en œuvre d’une réadaptation cardiovasculaire ciblée et l’introduction d’interventions visant à atténuer la gravité du COVID long.
INTRODUCTION:
Le COVID-19 continue d’avoir un impact majeur sur la morbidité et la mortalité mondiales, avec plus de 10 millions de décès et près d’un milliard de cas documentés, des chiffres probablement sous-estimés. Les complications cardiovasculaires sont fréquentes, tant pendant la phase aiguë que dans le cadre du COVID long. Les complications peuvent inclure des affections inflammatoires (myocardite, péricardite), des événements thrombotiques (infarctus, AVC, embolie pulmonaire), des troubles du rythme ou une insuffisance cardiaque. Ces symptômes, souvent non spécifiques (douleur thoracique, essoufflement, fatigue, étourdissements), peuvent persister pendant des mois, voire des années, rendant le diagnostic et la prise en charge difficiles.
On estime que plus de 20 % des patients atteints de COVID présentent des symptômes cardiaques à long terme, ce qui pourrait concerner 2 à 5 % de toutes les personnes infectées. Face à ces enjeux ce consensus guide la prévention cardiovasculaire chez les patients infectés, afin d’améliorer leur prise en charge et leurs résultats cliniques.
Conseils cliniques
-
Les antécédents d’infection à la COVID-19 sont associés à un risque accru d’événements cardiovasculaires chez certaines personnes.
-
L’identification précoce et la prise en charge proactive des facteurs de risque peuvent être importantes pour prévenir les complications cardiovasculaires dues au COVID long.
-
Les stratégies de prévention globales devraient intégrer des interventions pharmacologiques et des modifications du mode de vie afin de prendre en compte les risques cardiovasculaires résiduels.
MÉTHODES :
La revue systématique synthétisant les données disponibles sur le COVID long cardiaque jusqu’en juillet 2023 a servi de référence fondamentale pour cette déclaration consensuelle.
Investigations et traitement des manifestations cardiovasculaires du COVID long
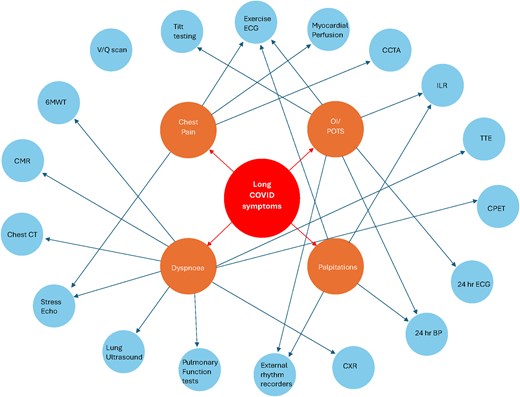
Le COVID long se caractérise par des symptômes cardiovasculaires persistants, notamment des douleurs thoraciques, des palpitations, une dyspnée et une intolérance à l’oxygène, qui peuvent persister plusieurs mois après l’infection aiguë. Ces symptômes peuvent survenir même chez des personnes sans antécédents cardiaques, soulignant ainsi l’impact cardiovasculaire important de cette affection.
La fonction cardiaque est régulée par des interactions complexes entre les cardiomyocytes, les fibroblastes, les cellules endothéliales et les cytokines. Les cardiomyocytes facilitent la contraction cardiaque, les fibroblastes assurent le soutien structurel et contribuent à la réparation tissulaire, tandis que les cytokines modulent les réponses immunitaires et l’inflammation. Lors de périodes de stress ou de lésion cardiaque, comme pendant une infection aiguë au SARS-CoV-2, cet équilibre est perturbé, entraînant une signalisation anormale, une inflammation persistante, un remodelage défavorable et des symptômes évocateurs d’insuffisance cardiaque. Cette section explore les mécanismes potentiels sous-jacents à ces symptômes et décrit une approche diagnostique progressive afin de faciliter un diagnostic précis, tout en reconnaissant que certains cas peuvent impliquer une pathologie organique sous-jacente nécessitant un traitement ciblé.
Des études récentes menées auprès de personnes ayant survécu à la COVID-19 indiquent un risque accru d’événements cardiovasculaires, notamment d’insuffisance cardiaque, de cardiomyopathie ischémique et non ischémique, d’arrêt cardiaque et de choc cardiogénique. Ce risque est plus marqué en phase aiguë, mais peut persister à des degrés variables, même chez les personnes vaccinées. Entre 3 et 9 mois après l’hospitalisation, ces patients présentent également un risque accru de consultations aux urgences ou d’hospitalisations pour des affections telles que le diabète, l’hypertension et l’insuffisance cardiaque, comparativement aux personnes n’ayant jamais contracté la COVID-19. Les patients souffrant d’angor dans le cadre d’un COVID long présentent également une forte prévalence d’ischémie myocardique sans obstruction coronarienne, principalement liée à un dysfonctionnement de la voie endothélium-dépendante. Le diagnostic d’une insuffisance cardiaque d’apparition récente chez ces patients nécessite le respect des recommandations établies, car les symptômes du COVID long, notamment la dyspnée persistante, la fatigue, les douleurs thoraciques et les palpitations, peuvent se confondre avec ceux de l’insuffisance cardiaque. Une évaluation complète, comprenant un examen physique, une imagerie cardiaque multimodale et des analyses de laboratoire, est essentielle pour identifier les patients à risque et est résumée dans [figures, tables] (modalités d’imagerie adaptées à la symptomatologie).
Besoins non satisfaits et perspectives d’avenir
Alors que notre compréhension du COVID-19 et de ses implications cardiovasculaires continue de progresser, d’importantes lacunes persistent, notamment concernant les séquelles cardiovasculaires à long terme de la COVID-19, les effets des réinfections et les effets indésirables liés à la vaccination, tels que la myocardite. Nos stratégies thérapeutiques dans ces domaines reposent sur des données probantes limitées, soulignant l’urgence de mener des études plus complètes et longitudinales. L’interaction entre la COVID-19 et les affections cardiovasculaires préexistantes justifie également des recherches approfondies afin d’affiner les mesures préventives et de développer des approches thérapeutiques individualisées.
Un axe de recherche essentiel est l’établissement de lignes directrices plus claires pour la réadaptation cardiovasculaire adaptée aux personnes ayant survécu à la COVID-19, en particulier celles souffrant de COVID long. Le rôle des modifications du mode de vie, des traitements pharmacologiques et des nouveaux outils diagnostiques reste mal compris, ce qui souligne la nécessité de mener des recherches auprès de populations diversifiées, notamment auprès des femmes et des personnes en situation de précarité. Des stratégies de réadaptation personnalisées seront indispensables pour améliorer les résultats cardiovasculaires à long terme chez ces patients.
À l’avenir, la collaboration internationale en matière de recherche sera essentielle pour répondre à ces besoins non satisfaits, permettant ainsi le développement d’interventions plus ciblées et contribuant à la réduction du fardeau cardiovasculaire mondial associé à la COVID-19.
CONCLUSIONS
Les conséquences cardiovasculaires de la COVID-19, qu’il s’agisse de l’infection aiguë, du COVID long ou des complications liées à la vaccination, constituent toujours un enjeu majeur de santé publique. Cette déclaration de consensus clinique souligne la nécessité d’un dépistage précoce de la COVID longue, d’une prise en charge personnalisée, d’une réadaptation individualisée, d’une pharmacothérapie fondée sur des données probantes, d’interventions (lorsqu’elles sont disponibles et décrites dans cette déclaration) et d’un suivi à long terme afin d’atténuer les complications cardiovasculaires.
La prise en charge multidisciplinaire et les plans de traitement personnalisés sont essentiels à l’amélioration des résultats, tandis que la poursuite des recherches sur les effets cardiovasculaires à long terme de la COVID-19 demeure cruciale. Les études futures doivent privilégier l’optimisation des stratégies de prévention et de réadaptation, combler les lacunes actuelles dans les connaissances et formuler des recommandations fondées sur des données probantes afin de gérer efficacement l’évolution des répercussions cardiovasculaires de la pandémie.
11 – Incidence de l’hypertension artérielle d’apparition récente après la COVID-19 : comparaison avec la grippe
AHAIASA Journals, 2023 : Lien
ARRIÈRE-PLAN
Le SARS-CoV-2 peut déclencher une hypertension persistante d’apparition récente. Cette étude a examiné l’incidence et les facteurs de risque associés à l’apparition d’une hypertension persistante d’apparition récente au cours d’une hospitalisation pour COVID-19 et lors d’un suivi d’environ 6 mois par rapport à la grippe.
METHODES
Cette étude observationnelle rétrospective a été menée dans un important système de santé universitaire de la ville de New York. Les participants comprenaient 45 398 patients atteints de COVID-19 (de mars 2020 à août 2022) et 13 864 patients grippaux (de janvier 2018 à août 2022) sans antécédents d’hypertension.
RÉSULTATS
Au suivi à 6 mois, une nouvelle hypertension persistante a été observée chez 20,6 % des patients hospitalisés atteints de la COVID-19 et 10,85 % des patients non hospitalisés atteints de la COVID-19. L’incidence de l’hypertension persistante chez les patients hospitalisés n’a pas varié au cours de la pandémie, alors que celle des patients hospitalisés a diminué de 20 % en mars 2020 à ≈10 % en octobre 2020 (R 2 = 0,79, P = 0,003) pour ensuite stagner par la suite. Les patients hospitalisés atteints de la COVID-19 étaient 2,23 fois ([IC à 95 %, 1,48-3,54] ; P < 0,001) et les patients non hospitalisés atteints de la COVID-19 étaient 1,52 fois ([IC à 95 %, 1,22-1,90] ; P < 0,01) plus susceptibles de développer une hypertension persistante que leurs homologues grippaux. L’hypertension persistante était plus fréquente chez les personnes âgées, les hommes, les Noirs, les patients présentant des comorbidités préexistantes (broncho-pneumopathie chronique obstructive, maladie coronarienne, maladie rénale chronique) et ceux traités par des médicaments presseurs et corticostéroïdes. Les modèles mathématiques ont prédit l’hypertension persistante avec une précision de 79 % à 86 %. De plus, 21,0 % des patients hospitalisés pour COVID-19 sans hypertension antérieure ont développé une hypertension pendant l’hospitalisation pour COVID-19.
CONCLUSIONS
L’incidence de l’hypertension persistante d’apparition récente chez les patients atteints de la COVID-19 est plus élevée que chez les patients atteints de la grippe, ce qui constitue probablement un fardeau sanitaire majeur compte tenu du nombre considérable de patients atteints de la COVID-19. Nous avons étudié l’incidence et les facteurs de risque associés à l’hypertension persistante d’apparition récente pendant la COVID-19 et au suivi à 6 mois par rapport à la grippe. Nous avons constaté que l’incidence de l’hypertension persistante d’apparition récente chez les patients atteints de COVID-19 était significativement plus élevée que chez les patients atteints de grippe. Le nombre massif de personnes touchées par la COVID-19 suggère que l’hypertension persistante d’apparition récente pourrait être une séquelle cardiovasculaire post-infection majeure au niveau de la population. Ces résultats devraient sensibiliser davantage au dépistage de l’hypertension après une maladie COVID-19.
12 – Évaluation du ventricule gauche par échocardiographie 3D dans le syndrome post-COVID-19 (Covid long)
Springer Nature Link 2025 : Lien
BACKGROUND
Le COVID-19 est une maladie qui affecte différents organes, et qui aurait un impact sur la fonction du muscle cardiaque. Les premiers résultats obtenus chez les patients hospitalisés pour COVID-19 indiquent la présence de lésions myocardiques caractérisées par une augmentation du taux de troponine ultrasensible. Les causes de ces lésions myocardiques sont diverses et encore mal comprises.
MÉTHODES
L’échocardiographie tridimensionnelle (3DE) mesure avec précision le volume du ventricule gauche (VG) et sa fonction, à la fois globalement et régionalement. Elle élimine la nature subjective de l’échocardiographie bidimensionnelle (2DE) lors de l’évaluation des irrégularités dans le mouvement des parois du VG. Cette étude visait à évaluer la fonction systolique du ventricule gauche chez 150 personnes qui s’étaient rétablies de la COVID-19 et qui présentaient des symptômes post-COVID tels que dyspnée, palpitations ou gêne thoracique à l’aide de la 3DE.
RÉSULTATS
Notre étude a révélé une corrélation statistique notable ( valeur p de > 0,001) entre les patients atteints du syndrome post-COVID-19 et qui ont signalé des symptômes persistants tels qu’un essoufflement ou une gêne thoracique, et divers schémas de contrainte échocardiographique 3D (le pourcentage GLS moyen dans le groupe des cas était de − 16,06 ± 4,36, alors que dans le groupe témoin, il était de − 17,9 ± 2,57). Un dysfonctionnement myocardique subclinique, comme le montre une diminution de la contrainte longitudinale globale du ventricule gauche (GLS-VG), est fréquent chez plus de 85 % des patients atteints du syndrome post-COVID-19. Cependant, des indicateurs plus fréquemment observés de la fonction ventriculaire gauche (VG), tels qu’une fraction d’éjection (FE) plus faible et des anomalies du mouvement de la paroi, étaient moins fréquemment trouvés.
CONCLUSIONS
Les résultats de notre étude suggèrent que les personnes qui ont développé des symptômes tels que des difficultés respiratoires, un rythme cardiaque rapide ou des douleurs thoraciques après leur rétablissement de la COVID-19 ont présenté une réduction de la déformation longitudinale globale du ventricule gauche (LV-GLS) telle que mesurée par échocardiographie tridimensionnelle (3DE). Les recherches en cours visent à déterminer le mécanisme des lésions cardiaques dans l’infection par la COVID-19.